Усилие при выкручивании титановых имплантатов с поверхностью,
обработанной лазером, из большеберцовой кости кролика.
Сунг Ам Чо, Санг-Кио Юнг
Факультет протезирования, Стоматологический институт, Национальный Университет Киунг-Пук,
101 2 Гу Фонг-Ин Донг, Юнг-Гу, Дае-Гу 700 422, Южная Корея.
Результаты получены 26 октября 2002 года, приняты 13 мая 2003 года
_____________________________________________________________________________________________________________________обработанной лазером, из большеберцовой кости кролика.
Сунг Ам Чо, Санг-Кио Юнг
Факультет протезирования, Стоматологический институт, Национальный Университет Киунг-Пук,
101 2 Гу Фонг-Ин Донг, Юнг-Гу, Дае-Гу 700 422, Южная Корея.
Результаты получены 26 октября 2002 года, приняты 13 мая 2003 года
Краткое изложение
Цель данного исследования оценить значение различных текстур поверхности на примере сравнения усилия при выкручивании
имплантатов с лазерной обработкой поверхности и имплантатов с машинной обработкой поверхности через 8 недель после установки
в большеберцовую кость подопытного кролика.
Всего было взято 14 имплантатов из технически чистого титана длиной 5 мм и диаметром 3.75 мм, которые были разделены на 2
Группа А: 7 имплантатов с машинной обработкой поверхности
Группа B: 7 имплантатов с лазерной обработкой поверхности (Метод CSM implant, компания CSM, Даегу, Корея).
Для сравнения структуры поверхности имплантатов с лазерной и машинной обработкой использовался сканирующий электронный
микроскоп (Hitachi S-4200, Япония).
Установка имплантатов производилась согласно протокола Branemark: имплантаты с машинной обработкой поверхности устанавлива-
лись в правую большеберцовую кость подопытного кролика, имплантаты с лазерной обработкой поверхности – в левую.
Через восемь недель после операции семь подопытных кроликов были умерщвлены. Места установки имплантатов были открыты,
кость и мягкие ткани, которые сформировались поверх имплантатов были осторожно удалены. Впоследствии усилие при выкручива-
нии (14 шт) измерялось при помощи цифрового моментомера (Mark-10 Corporation, США).
Снимки поверхности имплантата, обработанной при помощи лазера, полученные при помощи сканирующего электронного микро-
скопа, показали поверхность с сотовой структурой, с глубокими и ровными и маленькими порами, в то время как поверх ность с ма-
шинной обработкой представляла собой относительно ровную поверхность с типичными микроскопическими желобками. Через в о-
семь недель после установки имплантатов, среднее усилие при выкручивании составило 23.59±3.71 Нсм для имплантатов с машинной
обработкой поверхности и 62.57±10.44 Нсм для имплантатов с лазерной обработкой поверхности. Измерения усилия при выкручива-
нии показали статистически значительные различия между группой с машинной обработкой поверхности и группой с лазерной обра-
боткой поверхности (p=0.00055) (Знаковый ранговый критерий Уилкоксона).
Группа с лазерной обработкой поверхности показала более высокие значения усилия при выкручивании, чем контрольная группа с
машинной обработкой поверхности.
1. Введение
В попытке улучшить качество стоматологических имплантатов использовалось множество различных моди-
фикаций обработки поверхности. В отличие от других техник, впервые был применен способ лазерной обра-
ботки поверхности имплантата *1+. Данный способ позволяет достигать уникальной микроструктуры с очень
сильно увеличенной твердостью, стойкостью к коррозии и другими полезными свойствами *1+. Также данный
метод показал, что лазерная обработка поверхности –это новый метод обработки, при помощи которого дос-
тигается высокая чистота поверхности с достаточной шероховатостью для улучшенной остеоинтеграции *2+.
Развитие и использование данных модификаций обработки поверхности имплантата были основаны на тео-
рии, которая заключалась в том, что лучший контакт кости и имплантата может достигаться за счет увели-
ченной топографии или поверхности имплантата.Для определения контакта имплантата с костью ис-
пользовался метод определения усилия при выкручивании.
Цель данного исследования оценить значение раз личных способов обработки поверхности стоматологи-
ческого имплантата путем сравнения усилия при выкручивании в остальном идентичных имплантатов с лазер-
ной обработкой поверхности и с машинной обработкой поверхности из технически чистого титана.
2. Материал и методы
2.1. Подопытные животные и анестезия
Десять взрослых белых кроликов весом от 3.1 до 4.0 кг использовались при проведении данного исследова-
ния. Животным ввели дозу анестезии, которая состояла из комбинации Кетамина (Ketara®, Yuhan Corporation,
Seoul, Korea, 44mg/kg веса), и Ксилазин (Rompun® , Bayer Korea, Seoul, Korea, 7mg/kg веса) внутримышечно.
Перед операцией 1.8 мл Лидокаина 2% (Yuhan Corporation, Seoul, Korea) ввели местно в места хирургического
вмешательства в ткани. После операции животным ввели внутримышечно антибиотики (Baytril R Bayer Korea,
Seoul, Korea) по 0.3 мг, анальгетик (Nobin R, Bayer Korea,Seoul, Korea) по 1 мл, метаболит (Catosal R , Bayer Korea,
Seoul, Korea) по 1 мг.
Животным позволялась полная нагрузка на ноги и движение без ограничений после операции. Через во-
семь недель после хирургического вмешательства животные были умерщвлены при помощи большой дозы
анестезии.
2.2. Обработка поверхности
Всего было взято 14 имплантатов из технически чистого титана длиной 5 мм и диаметром 3.75 мм, которые
были разделены на 2 группы:
Группа А: 7 имплантатов с машинной обработкой по-
верхности
Группа B: 7 имплантатов с лазерной обработкой по-
верхности (Метод CSM implant, компания CSM, Даегу,
Корея).
Для того, чтобы убедиться в том, что лазерная обработка никак не повлияла на форму имплантатов, ис-
пользовался микроскоп Nikon Measurescope 10 (Nikon,Токио, Япония), оборудованный цифровым счетчиком.
При помощи данного микроскопа измерялись внешние диаметры пяти случайно отобранных имплантатов из
каждой группы.
2.3. Сканирующий электронный микроскоп
Для сравнения структуры поверхности имплантатов с лазерной (Группа B) и машинной обработкой (Группа А)
использовался сканирующий электронный микроскоп (Hitachi S-4200, Япония).
2.4. Энергодисперсионная спектроскопия
Энергодисперсионный рентгеноспектральный анализ (EDAX: Horiba EX-300, Япония) использовался для оценки
элементного анализа образцов.
2.5. Установка имплантатов
Перед операцией места установки имплантатов были побриты и обработаны йодом и 70%-м спиртом. При
помощи разрезов на коже, мышцах и надкостнице была обнажена кость. Места для установки имплантатов на
кости были подготовлены при помощи круглого сверла 2мм в диаметре, и винтового сверла 3мм в диаметре
при обильной подаче физраствора и на низкой скорости вращения. Имплантаты с машинной обработкой по-
верхности (Группа A) устанавливались в правую большеберцовую кость подопытного кролика, имплантаты с
лазерной обработкой поверхности (Группа B) – в левую.
Все имплантаты устанавливались только в первый кортикальный слой. После установки имплантатов над-
костница и мышцы были зашиты при помощи рассасывающейся нити.
2.6. Измерение усилия при выкручивании
Через восемь недель после операции семь подопытных кроликов были умерщвлены. Места установки им-
плантатов были открыты, кость и мягкие ткани, которые сформировались поверх имплантатов были осторожно
удалены. Впоследствии усилие при выкручивании (14 шт) измерялось при помощи цифрового моментомера
(Mark-10 Corporation, США). Результат был установлен путем замера максимального усилия при выкручивании,
при котором между имплантатом и костью происходил разлом.
2.7. Статистический анализ
Для определения значения вероятности для анализа усилия при выкручивании у двух групп использовался
Знаковый ранговый критерий Уилкоксона.
3. Результат
3.1. Топографическая оценка
При использовании микроскопа Nikon Measurescope 10 были выявлены лишь незначительные различия в
средних значениях внешнего диаметра между группами. Средние значения внешних диаметров составляли
3.751 мм для контрольной группы с машинной обработкой поверхности и 3.737 мм для группы с лазерной об-
работкой поверхности.
Исследование с помощью сканирующего электронного микроскопа имплантатов с лазерной обработкой по-
верхности и имплантатов с машинной обработкой поверхности продемонстрировало микроскопические раз-
личия в топографии поверхности. Эти различия представлены на рис.1. Лазер создал поверхность с сотовой
структурой, с глубокими и ровными и маленькими порами, в то время как поверхность с машинной обработ-
кой представляла собой относительно ровную поверхность с типичными микроскопическими желобками.
Расстояние между порами у имплантата с лазерной поверхностью составило 10-12 мкм.

Рис.1. Фотография сканирующей электронной микроскопии имплантата с машинной обработкой поверх-
ности (х500) с желобками относительно гладкой поверхности.
3.2. Энергодисперсионная спектроскопия
Результаты исследования при помощи EDAX (Horiba EX-300, Япония) не показали образования какого-либо
загрязнения во время обработки поверхности при помощи лазера (рис.2).

Рис.2. Поверхность, обработанная лазером. Относительно ровные поры правильной формы (х500).
3.3. Усилие при выкручивании
Через восемь недель после установки имплантатов,средний момент вывинчивания составил 23.59±3.71 Нсм
для имплантатов с машинной обработкой поверхности и 62.57±10.44 Нсм для имплантатов с лазерной обработ-
кой поверхности. Результаты измерений приведены в Таблице 1.
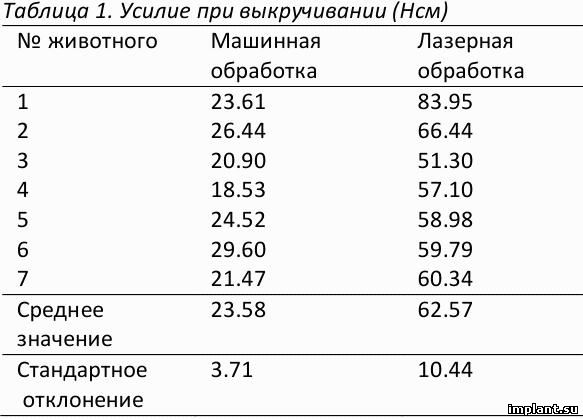
Измерения усилия при выкручивании показали статистически значительные различия между группой с ма-
шинной обработкой поверхности и группой с лазерной обработкой поверхности (p<0.001). Более высокие пока-
затели усилия при выкручивании соответствовали имплантатам с лазерной обработкой поверхности, самые
низкие показатели продемонстрировали имплантаты с машинной обработкой поверхности.
4. Обсуждение
Согласно исследованию Робертса и др. *4+, требуется 6 недель для того, чтобы перепончатая ретикулофиб-
розная кость кролика была замещена пластинчатой костью с адекватной прочностью, способной нести на-
грузку. Но мы взяли период интеграции равный 8 неделям потому, что быстрый рост кости является ключевым
моментом для механической целостности соединения имплантата и кости. Более долгие периоды (12 недель
или 6 месяцев) могли бы понадобиться при необходимости исследования возможных различий в усилиях при
выкручивании и контакта кости и имплантата.
Кордиоли и др. *5+ в своем исследовании говорит о том, что среднее усилие при выкручивании было равно
25.28 Нсм для имплантатов с машинной обработкой, 26.85 Нсм для имплантатов с дробеструйной обработ-
кой, 29.57 для имплантатов с плазменным напылением и 40.85 Нсм для имплантатов с поверхностью, обрабо-
танной при помощи вытравливания кислотой при равных условиях.
Другие исследователи заявляют, что грубые поверхности имплантатов с различной топографией в общем
демонстрируют лучшее сцепление с костью, и более высокие значения усилия при выкручивании, чем им-
плантаты с машинной обработкой *6-10]. Используя транскортикальную модель, Томас и др. *10+ обнаружи-
ли, что имплантаты с грубой поверхностью имели намного более высокую силу сцепления с костью и более
высокую площадь сцепления, чем имплантаты с гладкой поверхностью. Бусер и др. *11+ обнаружили, что увели-
чение грубости поверхности имплантата напрямую связано с увеличением поверхности сцепления с костью.
Было выдвинуто предположение, что грубая поверхность имплантата является одним из самых важных фак-
торов, влияющих на успех имплантации.
Способ лазерной обработки поверхности – это в каком-то роде метод травления. Поэтому мы измеряли
различия внешних диаметров до и после лазерной обработки. Данные замеры показали лишь очень незначи-
тельные различия.
Данное исследование продемонстрировало, что группа имплантатов с лазерной обработкой показала
лучшие результаты по усилию при выкручивании имплантата по сравнению с группой имплантатов с ма-
шинной обработкой. Более высокие значения усилия при выкручивании имплантата могут объясняться более
сильным контактом имплантата с костью [12]. Более высокие значения усилия при выкручивании, проде-
монстрированные в данном исследовании, могут объясняться различиями в поверхности имплантата.
Веннерберг и др. (13) предположил, что высокая грубость поверхности имплантата является не единствен-
ным критерием, необходимым для оптимальной остеоинтеграции. Комбинация рисунка на поверхности им-
плантата, размер, распределение вершин и впадин, что характеризует топографию поверхности, может значи-
тельным образом повлиять на соприкосновение и механическое соединение поверхности кости и поверхно-
сти имплантата.
Механическое наложение основано на структуре микропор на поверхности имплантата, в то время как в
основе биохимической связи лежит кальциевая химия поверхности *14+. В эксперименте автора химический
состав двух поверхностей был одинаковым (рис.4), что означает, что роль кальция можно в расчет не прини-
мать.

Рис.3. Поверхность, обработанная лазером (х900).
Поры правильной формы и структуры, с интервалом
10-12 мкм, диаметром ±25 мкм и глубиной 20 мкм.
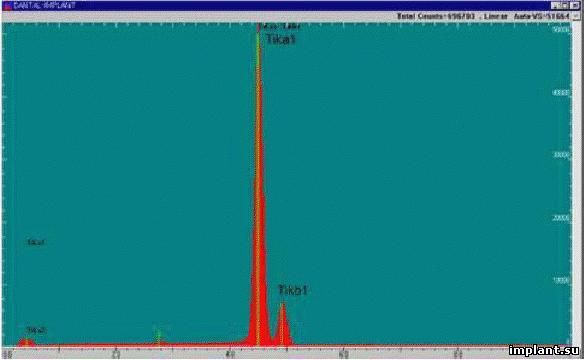
Рис.4. Энергодисперсионный рентгеноспектральный
анализ. Чистота поверхности, обработанной лазе-
ром. Присутствует только Титан (Ti).
Очевидно, что при увеличении толщины слоя оксида титана на поверхности имплантата увеличивается ответ-
ная реакция кости. Однако причиной этой усиленной ответной реакции может быть отнюдь не оксид сам по
себе, а изменения в других параметрах поверхности, как, например, микропоры поверхности и др. *14+.
Причина, почему имплантат с лазерной обработкой поверхности продемонстрировал лучшие результаты
усилия при выкручивании, чем имплантат с машинной обработкой поверхности, может заключаться в роли,
которую играет диаметр пор, поэтому очень важно обратить внимание на место соприкосновения пор с ко-
стью и на расстояние между порами.
Мустафа *15+ пишет, что пролиферация и дифференцировка клеток из нижней челюсти человека усиливает-
ся при использовании титанового имплантата с грубой поверхностью. Этого мнения придерживаются и другие
исследователи, которые также отмечают значение лазерной обработки поверхности имплантата для остео-
интеграции. Так Шигематсу и другие *18+, пишут в своем исследовании, что обработка поверхности с использо-
ванием лазера не изменяет механических свойств титана, так как лазерный луч нагревает до высоких темпера-
тур только поверхность титанового имплантата *18+.Гаггл и др. [2] анализировали четыре различных по-
верхности имплантата, каждая из которых была обработана своим методом. Особое внимание было уделено
методу лазерной обработки. Поверхности с машинной обработкой, напылением покрытия, обработанные ок-
сидом алюминия и лазером, были подвергнуты тщательному исследованию при помощи сканирующей
электронной микроскопии. Также на предмет загрязнения поверхности исследовались при помощи энерго-
дисперсионной рентгеновской спектроскопии (EDS-анализ).
Согласно Гагглу и др. *2+, поверхность имплантатов с лазерной обработкой продемонстрировала высокую
чистоту с достаточной шероховатостью для хорошей остеоинтеграции. Имплантаты с поверхностью, обрабо-
танной пескоструйкой с применением оксида алюминия оказались загрязнены частицами алюминия. Импланта-
ты с титановым плазменным напылением также продемонстрировали высокую степень загрязнения частица-
ми, которые не имеют свойств, способствующих остеоинтеграции *2+.
Исследование показало, что при лазерной обработке поверхности достигается получение пор правильной
формы и структуры с интервалом 10-12 мкм, диаметром 25 мкм и глубиной 20 мкм (рис.3).
Поверхность с лазерной обработкой, рассматриваемую в данном исследовании, необходимо сравнить на
предмет усилия при выкручивании и с другими поверхностями, как, например, титановое плазменное напы-
ление, пескоструйная обработка, обработка кислотой,или с поверхностью, которая объединила бы в себе все
эти способы.
5. Заключение
Группа имплантатов с лазерной обработкой поверхности достигла более высоких результатов усилия при
выкручивании, чем группа с машинной обработкой.В процессе измерений были выявлены статистически
значимые различия между группой с машинной обработкой поверхности (группа А) и группой с лазерной
обработкой поверхности (группа В).
Благодарность
Данное исследование проводилось при финансовой поддержке Корейского фонда развития науки и инже-
нерных технологий, Основной исследовательской программы.
Литература:
[1] Picraux ST, Pope LE. Tailored surface modification by ion implantation and laser treatment. Science 1984;226:615–22.
[2] Gaggl A, Schultes G, Muller WD, Karcher H. Scanning electron microscopical analysis of laser-treated titanium implants surfaces -
a comparative study. Biomaterials 2000;21:1067–73.
[3] Johansson CB, Albrektsson T. A removal torque and historphometric study of commercially pure niobium and titanium
implants in rabbit bone. Clin Oral Implant Res 1991;2:24–9.
[4] Roberts RW, Smith RK, Zibermann Y, Mozsary PG, Smith R. Osseous adaptation to continuous loading of rigid endosseous
implants. Am J Orthod 1984;86:95–111.
[5] Cordioli G, MajzoubZ, Piatelli A, Scarano A. Removal torque and histomorphometric investigation of 4 different titanium surfaces.
Int J Oral Maxillofac Implants 2000;15:668–74.
[6] Kieswetter K, Schwartz Z, Dean DD, Boyan BD. The role of implants surface characteristics in the healing of bone. Crit Rev
Oral Biol Med 1996;7(4):329–45.
[7] Boyan BD, Hummert TW, Dean DD. Role of material surfaces in regulating bone and cartilage cell response. Biomaterials 1996;
17:137–46.
[8] Cochran DL, Simpson J, Weber HP, Buser D. Attachment and growth of periodontal cells on smooth and rough titanium. Int J
Oral Maxillofac Implants 1994;9:289–97.
[9] Brunette DM. The effects of implant surface topography on the behavior of cells. Int J Oral Maxillofac Implants 1998;3:231–46.
[10] Thomas KA, Cook JKJF, Cook SD, Jarcho M. The effect of surface macrotexture and hydroxylapatite coating on the
mechanical strengths and histologic profiles of titanium implant materials. J Biomed Mater Res 1987;21:1395–414.
[11] Buser D, Schenk RK, Steinemann S, Fiorellini JP, Fox CH, Stich H. Influence of surface characteristics on bone integration of
titanium imlants, a histomorphometric study in miniature pigs. J Biomech Mater Res 1991;25:889–902.
[12] Johansson C, Albrektsson T. Integration of screw implants in the rabbit: a 1-year follow-up of removal torque of titanium
implants. Int J Oral Maxillofac Implants 1997;2:69–75.
[13] Wennerberg A, Albrektsson T, Lausmaa J. Torque and histomorphometric evaluation of c.p. titanium screws blasted with
25- mm and 75-mm sized particles of A12O3. J Biomed Mater Res1996;30:251–60.
[14] Sul YT. On the bone response to oxidized titanium implants.Ph.D. thesis, Department of Biomaterials/Handicap Research,
University of Gothenburg, Sweden; 2002.
[15] Mustafa K, Wennerberg A, Wroblewski J, Hultenby K, Lope BS,Arvidson K. Determining optimal surface roughness of TiO (2)
blasted titanium implant material for attachment, proliferation and differentiation of cells derived from human mandibular alveolar
bone. Clin Oral Implant Res 2001;12:515–25.
[16] Itala AI, Ylanen HO, Ekholm C, Karlsson KH, Aro HT. Pore diameter of more than 100 mm is not requisite for bone ingrowth
in rabbits. J Biomed Mater Res 2000;58:679–83.
[17] Muller WD, Seliger K, Meyer J. The improvement of adhesion of polymer of titanium surface after treatment with TEA-CO2 laser
irradiation. J Mater Sci Lett 1994;5:692–4.
[18] Shigematsu I, Nakamura M, Saitou N, Shimojima K. Surface hardening treatment of pure titanium by carbon dioxide laser. J
Mater Sci Lett 2000;19:967–70.

