|
Исследование
биобезопасности, биосовместимости и
остеокондуктивной активности
стоматологических титановых штифтов
Apolonia (Laser)
и Apolonia (RBM).
Сабурина
И.Н., Горкун А.А.
Лаборатория
клеточной биологии и патологии развития
ГУ НИИ
общей патологии и патофизиологии РАМН,
г.Москва
Цель:
исследовать штифты Apolonia
(Laser)
и Apolonia
(RBM)
на токсичность, сохранение стабильного
фенотипа клеток in
vitro,
оценить жизнеспособность и пролиферативную
активность клеток, их способность к
остеогенной дифференцировке после
заселения.
Для
оценки
цитотоксичности тестируемых
штифтов и их влияния на эффективность
прикрепления и пролиферации клеток
были взяты культивированные
постнатальные стромальные клетки
подкожной жировой ткани (СКЖТ).
Этап 1. Исследование
возможности прикрепления клеток к
титановым штифтам.
В
работе исследовали стоматологические
штифты
Apolonia
Implant (C3FW14 (Laser) 0900224, CSM) и
Apolonia
Implant (C3FW14(RBM)070124, CSM).
Стоматологические
титановые штифты в стерильных условиях
переносили из упаковок фирм-производителей
в четырехлуночные культуральные планшеты
(НПП ПанЭко, Пн4). К штифтам добавляли
суспензию клеток СКЖТ в количестве
60*103 клеток
на лунку. В отдельную лунку помещали
контрольную суспензию клеток в том же
количестве. Культивировали при 37°С в
СО2 инкубаторе
(Jouan,
США) в 0,5мл полной ростовой среды: ДМЕМ/F12
(1:1, С420:С600, НПП ПанЭко) с добавлением
глютамина (2мМ L-глютамин, Ф031, НПП ПанЭко),
гентамицина (50мкг/мл, А012, НПП ПанЭко),
ИТС (1:100) (инсулин, трансферин, селенит,
Ф065, НПП ПанЭко), и 10% эмбриональной
телячьей сыворотки (SH30109.03,
HyClone).
Замену среды производили каждые 2 дня.
В среднюю часть культурального планшета
для предотвращения испарения ростовой
среды наливали 2мл раствора Хенкса
(Р020, НПП ПанЭко).
Культуры
ежедневно микроскопировали, оценивая
степень конфлуэнтности и поведение
клеток в присутствии штифтов, с помощью
инвертированного светового микроскопа
CKX41 (Olympus,
Япония), фоторегистрацию осуществляли
с помощью цифровой камеры DP300
(Olympus,
Япония). При достижении клетками монослоя
осуществляли
пассирование культуры
с использованием 0,25% раствора трипсина
(П037, НПП ПанЭко), действие трипсина
инактивировали добавлением полной
ростовой среды. Избыток клеток переносили
из культуральных планшетов на новые
чашки Петри (Пк35, Пк60, Пк100, Corning,
НПП ПанЭко), культивировали их в течение
нескольких пассажей.
Этап
2. Оценка жизнеспособности
и пролиферации клеток после культивирования
со штифтами.
При
каждом пассаже производили подсчет
клеток в камере Горяева по схеме: считали
клетки расположенные в центре квадрата,
на его правой и нижней границах;
обсчитывали 25 больших квадратов (Рис.1).
Количество клеток в клеточной взвеси
вычисляли по формуле:
N =
N25×2500×Vкл.взвеси,
где N –
количество клеток во всей взвеси;
N25
– количество клеток в двадцати пяти
больших квадратах,
Vкл.взвеси
– общий объем клеточной взвеси.

Рис. 1. Камера
Горяева, в которой производился подсчет
клеток. Учитывали клетки, находящиеся
в пределах четырех средних квадратов
(один большой квадрат).
Для
оценки жизнеспособности клеток отбирали
50мкл суспензии и окрашивали 0,4% раствором
трипанового синего для определения
погибших клеток (Рис.2).
Анализ
ростовой кинетики клеточной популяции
осуществляли с помощью двух параметров:
коэффициента удвоения популяции (X)
и времени удвоения популяции (TD).
Данные параметры вычисляли с помощью
формул:
X
= [lgNh-lgNi]/lg2,
TD
= t*lg2/[lgNh-lgNi],
где Nh
– количество клеток пассажа №n,
Ni
– количество клеток пассажа №(n-1),
t
– время культивирования.
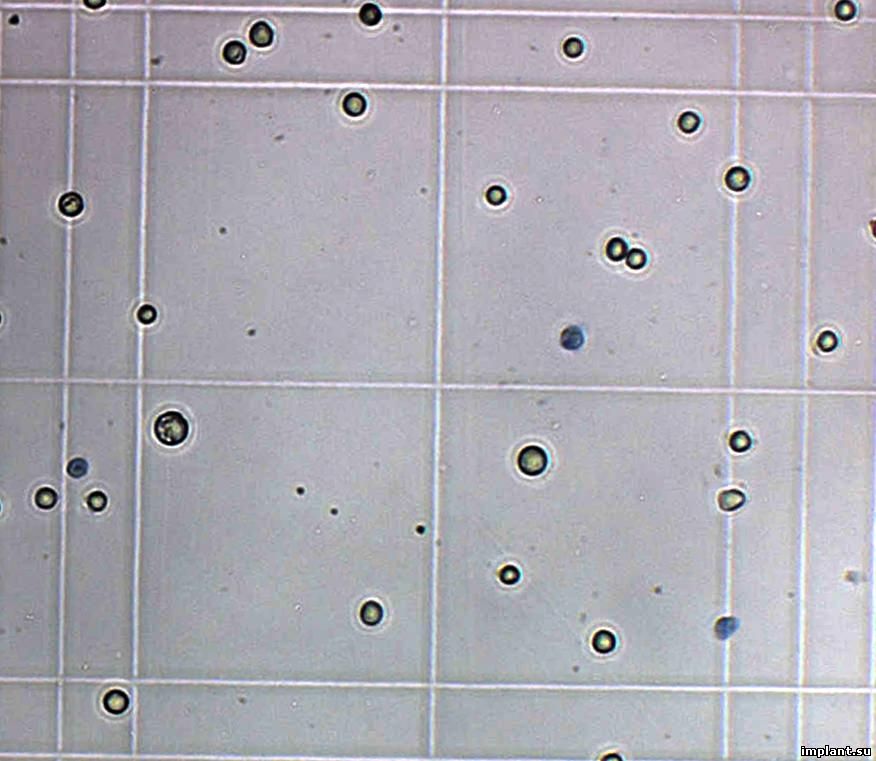
Рис.
2. Камера Горяева, в которой производили
подсчет количества жизнеспособных и
нежизнеспособных клеток. Нежизнеспособные
клетки, окрашенные трипановым синим,
указаны стрелками.
Этап
3. Исследование остеогенного
потенциала клеток после сокультивирования
со штифтами.
Для
определения сохранения клетками
способности дифференцироваться в
остеогенном направлении после
сокультивирования со штифтами клетки
снимали со штифтов и преддифференцировали
в индукционной среде по стандартной
принятой методике в течении 2 недель,
затем проводили молекулярное исследование
СКЖТ на экспрессию специфических
маркеров остеогенной дифференцировки:
остеонектин, остеокальцин и коллаген
по общепринятой методике.
Локус-специфическую
ПЦР проводили с использованием пар
праймеров для остеонектина (OSN
F,
OSN
R),
остеокальцина (OSC
F,
OSC
R)
и коллагена X
(COL
X
F,
COL
X
R)
Характеристики
праймеров, использованных в работе.
|
Праймеры
|
Последовательность
праймеров (5’ - 3’)
|
Размер
(N)
|
Размер
ожидаемого ПЦР продукта
|
Ссылка
|
|
OSN
F
OSN
R
|
CGT
TGG CTT GGA AGT TTC TCT T
TAT
AGG GCT TTC AGG CTC TTG C
|
22
22
|
188
пн
|
Maeng
et
al.,
2002
|
|
OSC
F
OSC
R
|
CAG
ACC TAG CAG ACA CCA TGAG
CGT
CCA TAC TTT CGA GGC AG
|
22
20
|
440
пн
|
Lisignoli
et
al.,
2001
|
|
COL
X F
COL
X R
|
ACA
AAG AGC GGA CAG AGA CC
AGA
AGG ACG AGT GGA CAT AC
|
20
20
|
442
пн
|
Handa
et
al.
2001
|
Результаты
Для
определения токсичности и биобезопасноти
титановыхвых штифтов на клетки оценивали
изменение морфологии клеток по мере
культивирования, индекс пролиферации
клеток после сокультивирования со
штифтами и количество поврежденных
клеток.
Значимых
различий в морфологии клеток между
экспериментальной и контрольной группами
выявлено не было. В течение всего периода
культивирования со штифтами клетки
сохраняли характерный для них
фибробластоподобный фенотип (Рис.3-6).
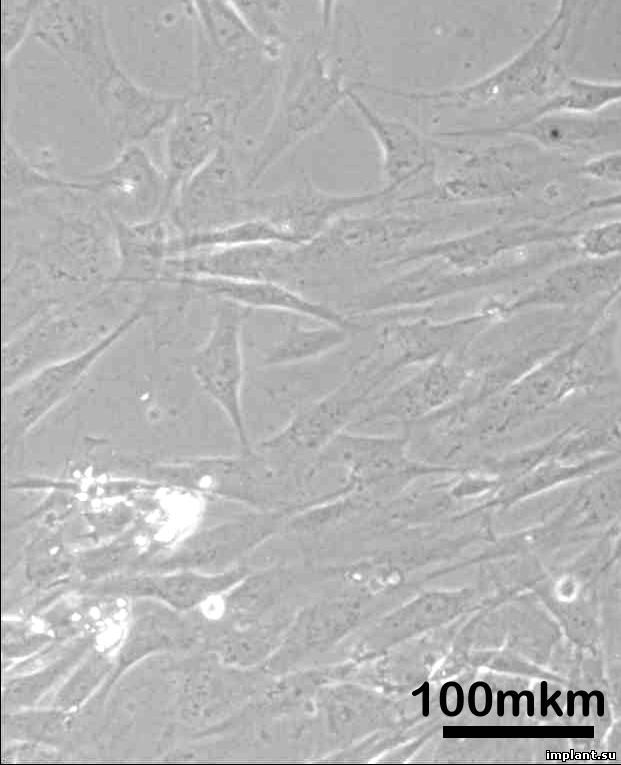 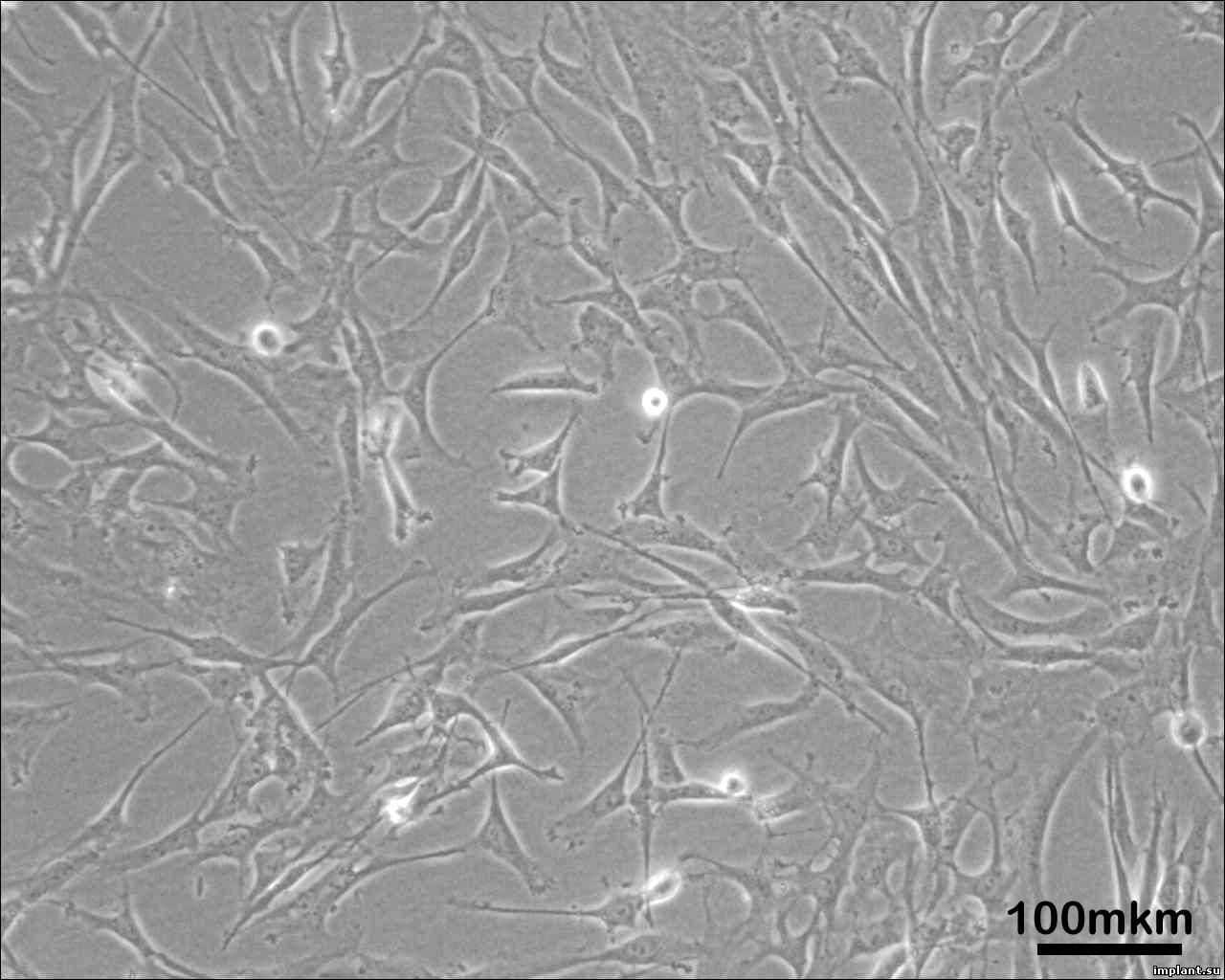 
Рис.3.
2 день культивирования клеток со штифтом
Apolonia
(Laser)
(А), со штифтом Apolonia
(RBM)
(Б) и контрольная группа клеток (В)
А
Б
В
Рис.4.
5 день культивирования клеток со штифтом
Apolonia
(Laser)
(А), со штифтом Apolonia
(RBM)
(Б) и контрольная группа клеток (В)
В
А
Б
Рис.5.
7 день культивирования клеток со штифтом
Apolonia
(Laser)
(А), со штифтом Apolonia
(RBM)
(Б) и контрольная группа клеток (В)
А
Б
В
Рис.6.
12 день культивирования клеток со штифтом
Apolonia
(Laser)
(А), со штифтом Apolonia
(RBM)
(Б) и контрольная группа клеток (В)
Клетки,
исследуемые после сокультивирования
со штифтами также не претерпели
морфологических изменений (Рис.7,8).
А
Б
В
Рис.7.
Культура клеток СКЖТ на первом пассаже
после сокультивирования со штифтом
Apolonia
(Laser)
(А), со штифтом Apolonia
(RBM)
(Б) и контрольная группа клеток (В)
А
Б
В
Рис.8. Культура клеток СКЖТ на
третьем пассаже после сокультивирования
со штифтом Apolonia
(Laser)
(А), со штифтом Apolonia
(RBM)
(Б) и контрольная группа клеток (В)
Анализ кинетики пролиферации
клеток из подкожного жира после
сокультивирования со штифтами показал
отсутствие снижения пролиферации в
сравнении с контрольной группой (Табл.1).
Таблица1. Значения параметров
пролиферации для клеток, сокультивируемых
со штифтами Apolonia
(Laser)
и Apolonia
(RBM),
и контрольной группы.
-
|
Исследуемая
группа клеток
|
р1
|
р2
|
р3
|
|
коэффициент
удвоения
|
|
Apolonia
(Laser)
|
1,63
|
2,43
|
1,17
|
|
Apolonia
(RBM)
|
2,12
|
2,52
|
0,74
|
|
Контроль
|
2,67
|
1,75
|
0,92
|
|
|
время
удвоения
|
|
Apolonia
(Laser)
|
29,45
|
19,83
|
47
|
|
Apolonia
(RBM)
|
22,61
|
18,98
|
51
|
|
Контроль
|
17,96
|
27,5
|
50
|
Чтобы
оценить жизнеспособность клеток после
сокультивирования со штифтами, при
каждом подсчете клеток отбирали 50мкл
клеточной суспензии и окрашивали ее
трипановым синим, способным проникать
в поврежденные клетки. После
сокультивирования со штифтами процент
живых клеток составил 96-99% (Табл.2).
Таблица2.
Данные по жизнеспособности для СКЖТ из
подкожного жира после сокультивирования
со штифтами Apolonia
(Laser)
и Apolonia
(RBM)
и контрольной группы.
|
общее кол-во клеток
|
кол-во живых клеток
|
кол-во мертвых клеток
|
% жизнеспособности
|
|
Apolonia
(Laser)
|
|
185000
|
181300
|
3700
|
98%
|
|
990000
|
964260
|
25740
|
97,4%
|
|
2235000
|
2167950
|
67050
|
97%
|
|
Apolonia (RBM)
|
|
260000
|
254150
|
5850
|
97,75%
|
|
1500000
|
1474500
|
25500
|
98,3%
|
|
2875000
|
2783000
|
92000
|
96,8%
|
|
Контроль
|
|
380000
|
373520
|
6480
|
98,3%
|
|
1275000
|
1240575
|
34425
|
97,3%
|
|
2475000
|
2403225
|
71775
|
98,1%
|
Анализ гибели
клеток после культивирования на образцах
Apolonia (Laser)
и Apolonia
(RBM)
Прослежено три
пассажа после культивирования на
образцах
Попарные сравнения
А) Apolonia (Laser)
и контроль
Б) Apolonia
(RBM)
и контроль
Клетки
прикреплялись как к самим штифтам,
обрастая их плотным слоем в течение
всего периода культивирования так и к
поверхности культуральных планшетов
(Рис.9-10).
А
Б
Рис.9.
4 день сокультивирования СКЖТ со штифтами
Apolonia
(Laser)
(А) и Apolonia
(RBM)
(Б). Стрелками указаны прикрепившиеся
клетки.
А
Б
Рис.10.
Плотная «шуба» из клеток по всей
поверхности штифтов на 12 день
сокультивирования СКЖТ со штифтами
Apolonia
(Laser)
(А) и Apolonia
(RBM)
(Б). Стрелками указаны прикрепившиеся
клетки.
На
двенадцатый день эксперимента, штифты
перенесли в новые культуральные планшеты
в полную ростовую среду без суспензии
клеток. Через несколько дней клетки
мигрировали со штифтов на поверхность
планшета, формируя клеточные скопления
(Рис.11).
А
Б
Рис.11.
Миграция клеток с поверхности штифтов
Apolonia
(Laser)
(A)
и Apolonia
(RBM)
(Б) на 7 день после переноса штифтов на
новые культуральные планшеты.
Результаты
молекулярного
исследования экспрессии
генов остеогенеза в клетках СКЖТ
после сокультивирования
со штифтами
Рис.12.
Очаги минерализации в культуре СКЖТ,
сокультивированной со штифтами, после
индукции остеогеной дифференцировки.
Фазовый контраст.
Через 2 недели культивирования
на индукционной среде клетки снимали
с пластика и исследовали экспрессию
генов, влияющих на остеогенез –
остеонектина, остеокальцина и коллагена
10. Для этого проводили выделение тотальной
РНК клеток и получали кДНК в результате
реакции обратной транскрипции. Полученную
кДНК использовали при постановке ПЦР
со специфическими праймерами к
интересующим генам. Контролем служила
кДНК клеток, культивированных в интактной
среде (без индукторов остеогенеза).
Была
обнаружена экспрессия остеонектина,
остеокальцина и коллагена 10 в исследуемых
клетках (Рис. 13.). Этот факт свидетельствует
о том, что клетки после сокультивирования
с титановыми
штифтами Apolonia
(Laser)
и Apolonia
(RBM)
не теряют способности становится
коммитированными в остеогенном
направлении.
а.
б. в.
Рис. 13.
Анализ экспрессии генов остеогенеза в
клетках СКЖТ после сокультивирования
со штифтами Apolonia
(Laser)
(1) и Apolonia
(RBM)
(2) и в контрольных клетках (К); а. экспрессия
коллагена Х; б. экспрессия остеонектина;
в. экспрессия остеокальцина
Вывод.
Титановые
штифты Apolonia
(Laser)
и Apolonia
(RBM)
- биобезопасны, не обладают
токсичностью по отношению к культивированным
постнатальным стромальным клеткам
подкожной жировой ткани (СКЖТ), которые
на протяжении всего времени сокультивирования
сохраняют высокую жизнеспособность и
формируют плотный монослой как на
поверхности самих штифтов, так и на
прилежащем пластике;
-
биосовместимы с культивированными на
них клетками, не блокируя, не снижая, а
поддерживая их высокий пролиферативный
потенциал;
- сами
штифты не блокируют и не изменяют
потенции заселенных на них клеток под
воздействием соответствующих индукторов
дифференцироваться в остеогенном
направлении, что подтверждается
экспрессией специфических маркеров
остеодифференцировки.
| 

